高考化学解题方法——物质结构篇
物质结构是高考大题中的相对最简单的一个,因为这个题的思维量不大,主要是考查对基础知识点的记忆。某些知识点的扩展对此题有所帮助,比如大π键。
- 基本概念
此部分内容分为原子结构,分子结构,晶体结构和配合物四个部分。我们首先梳理一下这些知识点的基础知识。
原子结构:
- 轨道形状
- 构造原理、洪特规则、保利不相容原理、半满与全满
- 电离能比较
分子结构:
- σ键,π键,大π键,氢键
- 键参数
- VSEPR
- 杂化轨道
晶体结构:
- 晶胞参数与计算
- 晶胞中原子的相对位置
- 考查较多的几个知识点
- 键角大小的比较:
- 先比较杂化类型,如sp > sp2 > sp3;杂化类型相同时,中心原子的孤对电子数越多键角越小,如CH4 > NH3 > H2O;杂化类型与中心原子的孤对电子数都相同时,成键电子对距离中心原子越远,键角越小,如NCl3 > PCl3, NCl3 > NF3
- 大π键:
简单来讲,只要是两个以上的原子的p轨道相互平行,且其中所含的电子数小于这些原子个数的2倍,就能形成大π键,若形成大π键的电子数与原子个数相近,那么这类大π键相对比较稳定,如苯环。这类存在大π键的体系称为共轭体系。由于是多个p轨道相互重叠,所以大π键中的电子可以在整个共轭体系中自有移动,所以具有了导电,1,4-加成,共面等特殊的性质。在有机中,只要分子结构中存在单双键交替的结构,就能形成大π键。
- 吡啶环:
苯环中一个C原子被N原子取代所形成的结构就是吡啶环。其中的N原子是sp2杂化,有一对孤对电子指向环外。所以,吡啶环与苯环结构相似,但是存在的一对孤对电子使其具有碱性和良好的配位能力。
- 缺电子原子和富电子原子:
由于缺电子的原子可以提供空轨道,富电子原子可以提供孤对电子,所以它们之间很容易形成配位键。常见的缺电子原子是IIIA元素,比如B和Al等。常见的富电子原子包括了VA,VIA,VIIA的原子,比如N, S, Cl等。形成的化合物中它们之间可以形成配位键,比如NH3BH3。
- 由于极化作用引起的晶体类型的变化:
极化作用高中并不涉及,但是常用熔沸点的异常来判断由于极化作用引起的同类型物质熔沸点异常低。极化作用通常出现在过渡金属元素与非金属元素形成的简单化合物中,非金属元素的半径越大,极化作用越强,熔沸点越低。当然还有其他的递变规律,比如溶解度和颜色的变化,但是一般高考涉及的比较少。
比如:
化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 377 | -24.12 | 38.3 | 155 |
- 分子的极性:
个人认为直接引入偶极矩的概念会简化分子极性的判断。共价键的极性是指,形成共价键的两原子之间,由于电负性会形成偶极矩。偶极矩是一个向量,方向由正电性原子指向负电性原子,大小是两原子电负性的差值。而分子的极性就是构成分子的所有的共价键的偶极矩之和。比如,CH4中的共价键为极性共价键,但偶极矩之和为0,所以是非极性分子;CH3Cl的共价键为极性共价键,但偶极矩之和显然不为0,所以是极性分子。
- 氢键的数目:
由于形成氢键的分子大小和中心原子上孤对电子的数目的原因,NH3分子之间形成1个氢键,H2O分子之间形成2个氢键,HF分子之间形成1个氢键。
三、高考例题
(2021山东卷)9.关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是( )
A.CH3OH为极性分子 B.N2H4空间结构为平面形
C.N2H4的沸点高于(CH3)2NNH2 D.CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同
解析:
A很容易;
B N2H4中的中心N原子是sp3杂化,所以空间构型肯定不是平面形;
C此选项考查的是分子间氢键的数目,N2H4每个分子与其他两个N2H4分子都可以形成氢键,但是(CH3)2NNH2每个分子只能与其他一个(CH3)2NNH2形成氢键。分子间形成氢键的数目越多,熔沸点自然越高;
D这三种原子的价层都有4对电子,所以都是sp3杂化。
(2020全国一卷)35. Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为 。
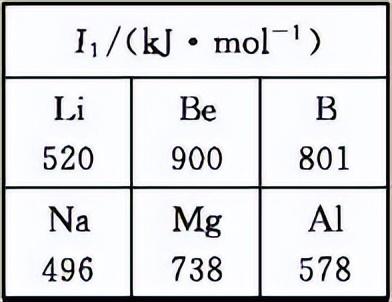
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是 ___________ 。 I1(Be)>I1(B)>I1(Li),原因是 __________________ 。
(3)磷酸根离子的空间构型为 ,其中P的价层电子对数为 、杂化轨道类型为 。
(4)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有 个。
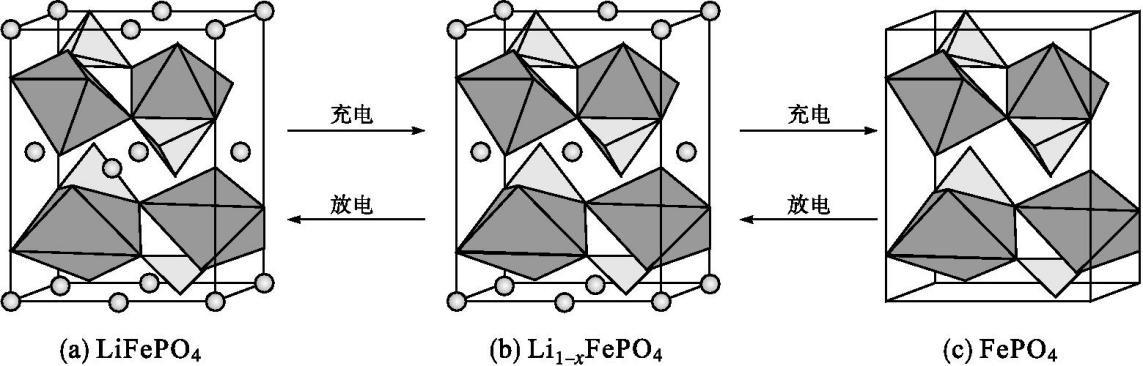
电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x= ,n(Fe2+)∶n(Fe3+)= 。
解析:
(1)这个空很简单,需要熟记;
(2)这是关于第一电离能大小比较的问题,难度不大;
(3)VSEPR和杂化轨道理论,难度不大;
(4)由图可知,Fe,P,O都在晶胞内部,Li就是顶点,棱心和面心上的小球,所以依据Li的个数很容易推出LiFePO4的单元数;后两个空的依据就是整个分子呈电中性,可以设其中Fe2+和Fe3+的个数分别为a和b,然后列方程组就可以把题解出来。
答案 :
(1)4∶5
(2)Na与Li同主族,Na的电子层数更多,原子半径大,易失电子 Li、Be、B同周期,核电荷数依次增加。Be为1s22s2全充满稳定结构,第一电离能最大。与Li相比,B核电荷数大,原子半径小,较难失去电子,第一电离能较大
(3)正四面体形 4 sp3
(4)4 13∶3
2022.07.12 初稿



